市一院医学伦理委员会召开伦理审查会议

医院医学伦理委员会在科教处办公区会议室召开第三季度伦理审查会议,对医院11项临床研究项目进行伦理快速审查和伦理会议审查。医学伦理委员会成员、项目负责人及相关人员按照疫情防控要求出席本次会议。医院医学伦理委员会主任赵玉良主持会议。
1)快速审查
主任委员赵玉良、主审委员李泳对医院近期获得的江苏大学2021年临床医学科技发展基金(自然科学类)项目中涉及人的4项临床研究项目和医院消化内科主任陈光侠开展的药物临床III期项目《甲磺酸帕拉德福韦片治疗慢性乙型肝炎的随机、双盲、阳性药平行对照、多中心、III期临床试验》递交的修正案审查项目进行伦理快速审查。
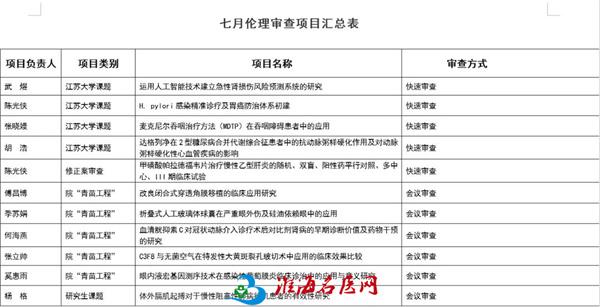
2)会议审查
医学伦理委员会在第三阶梯教室对医院“青苗工程”课题中涉及器官移植、高风险手术、并发症较多、涉及伦理问题的5个项目和1项研究生课题进行伦理会议审查。赵玉良主持会议,医院医学伦理委员、外院律师、社区人士、独立技术顾问参加会议,人数超过半数,符合法定要求。涉及的项目负责人进行了PPT汇报和答辩,委员们集体商议后投票表决,同意超过半数的项目,医学伦理委员会下达批件。

伦理知识科普《涉及人的生物医学研究伦理审查办法》(11号令)
2007年原卫生部发布了《涉及人的生物医学研究伦理审查办法(试行)》(以下简称《办法(试行)》)。该审查办法对宣传普及科研伦理原则,建立健全受试者保护机制,规范生物医学研究行为起到了积极促进作用,但随着生物医学研究的快速发展和伦理审查工作的逐步深入,《办法》(试行)作为规范性文件已不能满足发展需要,迫切需要根据当前临床研究管理工作要求,统筹规划制度建设,进一步细化伦理审查、知情同意内容和规程,加强涉及人的生物医学研究伦理审查工作的法制化建设,提高伦理审查制度的法律层级,从而进一步明确法律责任,更好地保障受试者的合法权益。
因此,在借鉴国内外管理经验的基础上,原国家卫生计生委充分调研听取各方面的意见,对《办法(试行)》进行修订,按照规章制定程序形成了《涉及人的生物医学研究伦理审查办法》(简称《11号令》)。《11号令》是为保护人的生命和健康,维护人的尊严,尊重和保护受试者的合法权益,规范涉及人的生物医学研究伦理审查工作而制定。由国家卫生和计划生育委员会于2016年10月12日作为“命令”发布,自2016年12月1日起施行。
《11号令》在内容方面进一步明确了医疗卫生伦理委员会的职责和任务;补充了伦理审查的原则、规程、标准和跟踪审查的相关内容;进一步阐述了知情同意的基本内容和操作规程。
关于伦理审查的研究活动范围,参照世界卫生组织《涉及人的生物医学研究国际伦理准则》和世界医学协会《赫尔辛基宣言》等文献,在《办法(试行)》基础上补充了:采用流行病学、社会学、心理学等方法收集、记录、使用、报告或储存有关人的样本、医疗记录、行为等科学研究资料的活动。
《11号令》在监管方面明确了医疗卫生机构是涉及人的生物医学研究伦理审查日常管理的责任主体;规定了县级以上地方卫生计生行政部门对伦理委员会备案和伦理审查监管的职责和监督检查的内容;明确了国家和省级医学伦理专家委员会在监管工作中各自的职责任务。此外,《11号令》还补充了中医药管理部门对中医药研究项目伦理审查工作的监督管理职责以及中医药研究伦理委员会的职责任务。
今年3-4月,为保护人的生命和健康,维护人的尊严,尊重和保护受试者的合法权益,促进生命科学和医学研究健康发展,国家卫健委将《涉及人的生物医学研究伦理审查办法》(国家卫生和计划生育委员会令第11号)中行之有效的制度安排进行总结,并结合新的形势和要求,会同有关部门起草了《涉及人的生命科学和医学研究伦理审查办法(征求意见稿)》,国家伦理审查监管工作持续改进中。

扫一扫,分享本页




